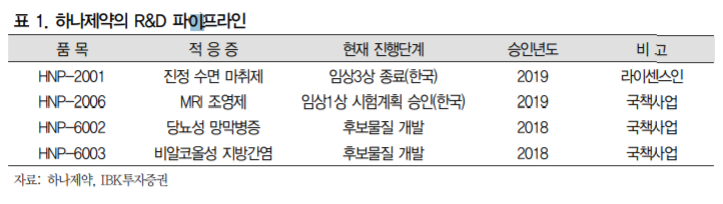
레미마졸람(HNP-2001, Remimazolam) 2019년 2월 28일 식약처 임상3상을 종료
화성 신공장 투자를 통해 주사제 중심의 생산Capa 증가 및 향후 레미마졸람 생산 대응
진정/수면마취제 신약 출시를 통한 중장기 성장동력 확보
2019년 예상실적은 매출액 1,710억원(+11.9% yoy), 영업이익 359억원(+6.8% yoy)
진정수면마취 신약 레미마졸람(HNP-2001, Remimazolam)이 2019년 2월 28일 식약처 임상3상을 종료하고 품목허가를 준비중. 레미마졸람의 국내 임상은 2017년 10 월 31일에 식약처 임상3상 IND승인을 받아 환자 모집 후 2018년 3월 21일에 임상 3상을 개시하였으며 2018년 10월 06일에 임상 3상 종료. 2019년 2월 28일에 임상 시험 결과보고서(CSR)를 수령하며 3상을 성공적으로 마무리.
日 라이센스인 계약자(Mundi Pharma)의 일본 PMDA허가 제출 시 50만EUR를 마일스톤으로 지급하는 계약. Mundi Pharma는 2018년에 임상 3상을 종료하고 2018 년 12월에 품목허가를 신청을 하였으며 이에 따라 하나제약에서 2019년 1월에 50만 EUR를 마일스톤으로 지급 완료. 진정수면마취제는 1990년경에 출시된 프로포폴 이 후에 신약 출시가 부재한 상황. 진정수면마취제 시장은 크게 1)전신마취의 유도 및 유지적응증과 2)수술 및 진단시 의식하진정(내시경류)으로 구분할 수 있으며 글로벌 시장규모는 5조원 규모로 추산. 국내 시장 규모는 약 1,000억원 규모.
2019년 예상실적은 매출액 1,710억원(+11.9% yoy), 영업이익 359억원(+6.8% yoy). 동사는 매년 20여개의 신제품을 출시하며 외형을 확대해 왔는데 올해에도 29개 신규 품목을 출시한다는 계획으로 품목확대에 따른 외형성장이 기대됨. 일부 품목은 First Generic 전략으로 9개월간의 독점판매권을 확보하며 브랜드 인지도를 구축한다는 전략. 동사는 진정/수면마취제 신약 출시를 통해 중장기 성장동력을 확보할 것으로 예상되며 생산라인 증설을 통한 성장전략이 중요한 투자 포인트.

장중에는 텔레그램을 통해
투자정보를 받아보시기 바랍니다
실시간으로 투자 도움이 되는 정보들과 찌라시를 올려드리고 있어
투자에 도움이 되실 것입니다^^
#여의도정보통
💯여의도정보통📈
🔺실시간 증권가 투자정보 찌라시🔺
t.me
레미마졸란 임상3상 종료, 품목허가 준비중
HNP-2001(레미마졸람) 국내 임상3상 종료
진정수면마취 신약 레미마졸람(HNP-2001, Remimazolam)이 2019년 2월 28일 식약 처 임상3상을 종료하고 품목허가를 준비중. 레미마졸람은 진정효과와 회복시간이 빠른 프로포롤(Propofol)과 안정성이 우수한 미다졸람(Midazolam)의 특징을 혼합한 화합물로 시장의 높은 관심이 기대되는 신약. 레미마졸란의 국내 임상은 2017년 10월 31일에 식약처 임상3상 IND승인을 받아 환자 모집 후 2018년 3월 21일에 임상 3상을 개시하 였으며 2018년 10월 6일에 임상 3상을 종료. 2019년 2월 28일에 임상시험 결과보고 서(CSR, Clinical Study Report)를 수령하며 성공적으로 마무리. 국내 임상은 전신마 취의 유도 및 유지 적응증으로 프로포폴을 대조군으로 비열등성 평가를 진행. 하나제약이 獨 PAION사와 맺은 레미마졸람 기술이전 계약 체결은 2013년 10월에 이루어졌으며 이에 따라 한국에서의 개발, 판매, 유통 및 제조 등에 관한 독점권한을 부여 받음. 권리기간은 제품 발매가 이루어진 시점으로부터 10년간 유지되며 이후 성과에 따라 재계약이 이루어질 수 있을 것으로 예상됨. 체결 당시 계약금(Upfront Payment)으로 지급된 금액이 100만EUR였으며 마일스톤은 3단계로 지급하는데 전체 금액은 200만EUR.
日 PMDA 허가 신청으로 마일스톤 1단계 지급 완료
마일스톤 지급 구조는 1)日 라이센스인 계약자(Mundi Pharma)의 일본 PMDA 허가제출 시 50만EUR를 지급. Mundi Pharma는 2018년에 임상 3상을 종료하고 2018년 12월에 품목허가를 신청을 하였으며 이에 따라 하나제약에서 2019년 1월에 50만EUR 를 마일스톤으로 지급 완료. 2)두번째 마일스톤은 Mundi사의 일본 PMDA허가시 50만 EUR을 지급하는 조건. 승인기간을 대략 9~12개월 정도 예상하면 2019년말경에는 일 본 PMDA승인 및 두번째 마일스톤 지급이 이루어 질 것으로 예상됨. 3)세번째 마일스 톤은 국내 허가 승인시 100만EUR를 지급하는 조건. 국내 승인은 일본 PMDA 품목허가 이후 9개월 정도 이후가 될 것으로 예상되는데 타임라인을 고려하면 신약 허가 및 출시 시점은 약 2020년말이 될 것으로 예상됨. 신약 출시 후 로열티 조건은 순매출의 10%.
레미마졸람 2,000여명 글로벌 다국가 임상진행
레미마졸람의 오리지널 개발사는 독일의 PAION사로 진정수면마취제 파트너사들과 함께 글로벌 임상 3상을 진행중. 글로벌 임상의 해외파트너사는 하나제약(한국), COSMO Pharmaceuticals(미국), MundiPharma(일본), PharmaScience(캐나다), TRPharma (터키), Humanwell Kanghua(중국), R-Pharma(러시아). PAION사는 임상 2상을 완료한 상태로 파트너 국가별로 개별적인 임상 3상을 진행. 글로벌 임상규모는 2,000여명 수준으로 여기서 10분의 1 수준인 200여명을 대상으로 국내 임상 3상을 진행.
진정수면마취제 국내시장 1,000억원 규모
진정수면마취제는 1990년경에 출시된 프로포폴 이후에 신약 출시가 부재한 상황. 진정 수면마취제 시장은 크게 1)전신마취의 유도 및 유지적응증과 2)수술 및 진단시 의식하 진정(내시경류)으로 구분. 진정수면마취제의 글로벌 시장규모는 5조원 규모 그리고 국 내 시장 규모는 약 1,000억원 규모로 추산.
레미마졸람 및 주사제 생산라인 증설 준비중
지속적인 매출액 증가에 따라 기존 화성공장 의약품 생산이 Full Capa수준에 이르렀고 이에 따라 신규 생산라인 증설을 진행중에 있음. 화성(하길) 신공장은 주사제 중심으로 라인을 구성한다는 계획으로 레미마졸람의 출시에 맞춰 EU GMP와 JGMP급 인증을 준비중에 있음. 건축/설비에 대한 투자 예산을 400억원 가량 잡고 있음. 투자에 필요한 자금은 IPO를 통해 확보한 1,050억원의 상장 자금을 활용한다는 계획. 착공은 2020년 상반기 중에 진행한다는 계획으로 준공시점은 2021년 그리고 GMP인증까지 마무리하고 실제 가동이 이루어지는 시점은 2022년 상반기가 될 것으로 예상됨.
2019E 예상실적 매출액 +11.9% yoy 영업이익 +6.8% yoy
2019년 예상실적은 매출액 1,710억원(+11.9% yoy), 영업이익 359억원(+6.8% yoy). 동사는 매년 20여개의 신제품을 출시하며 외형을 확대해 왔는데 올해에도 29개 신규 품목을 출시한다는 계획으로 품목확대에 따른 외형성장이 가능할 것으로 예상됨. 일부 품목은 First Generic 전략으로 9개월간의 독점판매권을 확보하며 브랜드 인지도를 구축한다는 전략. 동사는 진정/수면마취제 신약 출시를 통해 중장기 성장동력을 확보할 것으로 예상되며 생산라인 증설을 통한 성장전략이 중요한 투자 포인트로 투자매력도 는 높다고 판단.

'주식투자정보 📊' 카테고리의 다른 글
| #지티지웰니스 (219750) 하반기, 얼굴 필 일이 많다 (0) | 2019.06.20 |
|---|---|
| #전기차 시대, 모두가 즐거운 세상 (0) | 2019.06.20 |
| #카카오 주식투자 / 최근 이슈동향 점검 (0) | 2019.06.19 |
| #이노메트리 (302430) 2차전지 검사장비업체 (0) | 2019.06.19 |
| #파트론 (091700) 역대 최고가 2.6만원 경신을 향해! (0) | 2019.06.18 |



